Kuantum Sayıları
Atomun kuantum modeli içerisinde kuantum sayıları çok önemli bir kavramdır. Dört tane kuantum sayısı vardır.
- Başkuantum sayısı
- Açısal momentum kuantum sayısı
- Manyetik kuan sayısı
- Spin kuantum sayısı
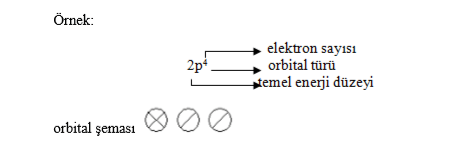
Başkuantum Sayısı (n)
Elektronların bulunduğu temel enerji düzeyini ve çekirdeğe olan uzaklığını belirtir. Başkuantum sayısı kuantum sayılarının ilki ve en temelidir.
n değerli için;
- n = 1 ⇒ K
- n = 2 ⇒ L
- n = 3 ⇒ M
- n = 4 ⇒ N
- n = 5 ⇒ O
Açısal Momentum (ikincil) Kuantum Sayısı (ℓ)
Açısal momentum kuantum sayısı elektron bulutlarının şekillerini ve şekil farklılığından oluşan enerji seviyesindeki değişmeleri göstermek için kullanılır.
ℓ ⇒ 0 ile n -1 arasında değer alır. (ℓ = 0,1,2,3, n-1)
Elektronların bulunduğu enerji seviyelerine başkuantum sayısı veya katman denir. Bunların dışında meydana gelen alt enerji seviyelerine ikincil katman denir ve s, p, d, f gibi harfler ile ifade edilir.
n = 1 için ℓ = 0
n = 2 için ℓ = 0, 1
n = 3 için ℓ = 0, 1, 2
n = 4 için ℓ = 0, 1, 2, 3
Olmaktadır.
Manyetik Kuantum Sayısı (mℓ)
İkincil katmanı oluşturan orbitallerin (s, p, d, f) sınırlandırılmış uzaydaki şekillerine denir.
mℓ = 2ℓ +1 formülü kadar ya da mℓ = -ℓ.. +ℓ aralığında değer alır.
ℓ = 0 ise mℓ = 0'dır. (s) İkincil katmandaki orbitallerden biri dış manyetik alana dik ise etkileşim olmaz.
Spin Kuantum Sayısı (ms)
Bir orbitalde birbiri ile aynı olan iki elektron yoktur. Orbitallerdeki elektronlar zıt yönlü farklı elektronlardır.
Aynı orbitalde eşit enerjili olsa dahi dönme yönleri terstir. Elektronların dönme yönlerini belirtmek için ( ↑) ve (↓) şeklinde oklar kullanılır. ms = +1/2 ve ms = -1/2 olarak belirtilir.
Yörüngeler
Aynı orbitalde eşit enerjili olsa dahi dönme yönleri terstir. Elektronların dönme yönlerini belirtmek için ( ↑) ve (↓) şeklinde oklar kullanılır. ms = +1/2 ve ms = -1/2 olarak belirtilir.
Yörüngeler
Elektronların çekirdek etrafında bulunma olasılığının en yüksek olduğu bölgeye orbital denir. Açısal momentum kuantum sayısına (l) bağlı olarak s, p, d ve f orbitalleri olmak üzere dört çeşit orbital vardır.
Elektronların çekirdek etrafında bulunma olasılığının en yüksek olduğu bölgeye orbital denir. Açısal momentum kuantum sayısına (l) bağlı olarak s, p, d ve f orbitalleri olmak üzere dört çeşit orbital vardır.
A) s Orbitali
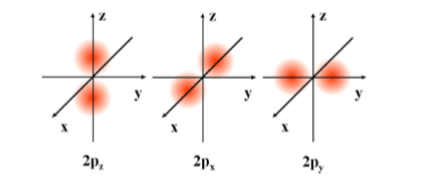
B) p Orbitali
p orbitalleri çekirdeğin iki tarafında zıt olarak yerleşmişlerdir. Kum torbasına benzeyen p orbitalleri üç orbitalden oluşur ve bu üç orbitalin enerjileri birbirine eşittir (px, py ve pz orbitalleri). En çok 6 elektron alır. İkincil kuantum sayısı l’nin 1 değerine karşılık gelir. Bir p orbitali hiç bir zaman çekirdekte bulunmaz, ikinci ve daha üst enerji seviyelerinde bulunmaktadır.
p orbitalleri çekirdeğin iki tarafında zıt olarak yerleşmişlerdir. Kum torbasına benzeyen p orbitalleri üç orbitalden oluşur ve bu üç orbitalin enerjileri birbirine eşittir (px, py ve pz orbitalleri). En çok 6 elektron alır. İkincil kuantum sayısı l’nin 1 değerine karşılık gelir. Bir p orbitali hiç bir zaman çekirdekte bulunmaz, ikinci ve daha üst enerji seviyelerinde bulunmaktadır.
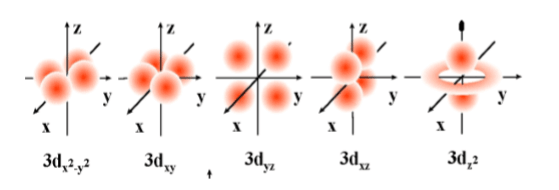
C) d Orbitali
D) f Orbitali
Dördüncü veya daha üst enerji düzeylerinde bulunur. 7 orbitalden oluşur ve en çok 14 elektron alır. İkincil kuantum sayısı l’nin 3 değerine karşılık gelir.
Dördüncü veya daha üst enerji düzeylerinde bulunur. 7 orbitalden oluşur ve en çok 14 elektron alır. İkincil kuantum sayısı l’nin 3 değerine karşılık gelir.
Orbitallere Elektron Dağılımı
Atom numarası bilinen bir atomun, elektron dağılımını gösteren şemaya atomun orbital şeması denir.
Elektronlar orbitallere dağılırken belli kurallar altında dağılırlar. Bu kuralları şöyle sıralayabiliriz:
- Çekirdeğe en yakın olan en düşük enerjili orbitalden başlanarak sıra ile en yüksek enerjili orbitale doğru doldurulur (Aufbau kuralı).
- Her orbital en fazla iki elektron alır. Bu elektronların spinleri (dönme yönleri) zıttır (Pauli kuralı).
- Eş enerjili orbitallere, önce elektronlar birer birer yerleştirilir. Sonra her bir orbitaldeki elektron sayısı ikiye tamamlanır (Hund kuralı).
Çok elektronlu atomlarda, elektronların orbitallere dağılışı farklılık gösterebilir. Bunu daha iyi anlamak için aşağıda verilen tabloyu inceleyelim.
Elektronların orbitallere yerleşimindeki sıra, spektroskobik ve manyetik yöntemlerle ortaya konulmuştur. Bunun sonucunda yukarıdaki elektron yerleşim sırası kurgulanmıştır.
“1s-2s-2p-3s-3p-4s-3d-4p-5s-4d-5p-6s-4f-5d-6p-7s-5f-6d-7p-8s” şeklinde sıralanmıştır.
Atom numarası bilinen bir atomun, elektron dağılımını gösteren şemaya atomun orbital şeması denir.
Elektronlar orbitallere dağılırken belli kurallar altında dağılırlar. Bu kuralları şöyle sıralayabiliriz:
- Çekirdeğe en yakın olan en düşük enerjili orbitalden başlanarak sıra ile en yüksek enerjili orbitale doğru doldurulur (Aufbau kuralı).
- Her orbital en fazla iki elektron alır. Bu elektronların spinleri (dönme yönleri) zıttır (Pauli kuralı).
- Eş enerjili orbitallere, önce elektronlar birer birer yerleştirilir. Sonra her bir orbitaldeki elektron sayısı ikiye tamamlanır (Hund kuralı).

Çok elektronlu atomlarda, elektronların orbitallere dağılışı farklılık gösterebilir. Bunu daha iyi anlamak için aşağıda verilen tabloyu inceleyelim.
Elektronların orbitallere yerleşimindeki sıra, spektroskobik ve manyetik yöntemlerle ortaya konulmuştur. Bunun sonucunda yukarıdaki elektron yerleşim sırası kurgulanmıştır.
“1s-2s-2p-3s-3p-4s-3d-4p-5s-4d-5p-6s-4f-5d-6p-7s-5f-6d-7p-8s” şeklinde sıralanmıştır.
1) Küresel Simetri
Eş enerjili orbitallerin yarı dolu veya tam dolu olması atoma küresel simetri özelliği kazandırır. Eş enerjili orbitallerin yarı dolu veya tam dolu olması durumunda elektronlar çekirdek tarafından daha kuvvetli çekildiğinden çekirdeğe yaklaşır ve atom çapı küçülür. Bu durum atoma kararlılık kazandırır. Örneğin; s orbitalinde 1 veya 2, p orbitalinde 3 veya 6, d orbitalinde 5 veya 10, f orbitalinde 7 veya 14 elektron bulunması atoma küresel simetrik yapı kazandırır.
Eş enerjili orbitallerin yarı dolu veya tam dolu olması atoma küresel simetri özelliği kazandırır. Eş enerjili orbitallerin yarı dolu veya tam dolu olması durumunda elektronlar çekirdek tarafından daha kuvvetli çekildiğinden çekirdeğe yaklaşır ve atom çapı küçülür. Bu durum atoma kararlılık kazandırır. Örneğin; s orbitalinde 1 veya 2, p orbitalinde 3 veya 6, d orbitalinde 5 veya 10, f orbitalinde 7 veya 14 elektron bulunması atoma küresel simetrik yapı kazandırır.
2) Bazı İyonların Örnek Orbital Dağılımları
İyonların elektronları orbitallere yerleştirilirken, öncelikle en az enerjili orbital doldurulmaya başlanır (Aufbau ilkesi). Örneğin atom numarası 7 olan azot atomunun elektron dağılımını şu şekilde yazabiliriz; “1s2 2s2 2p3)”. Bu şekildeki yazıma kısa spdf gösterimi denmektedir. Aynı atomun uzun spdf gösterimi ise şu şekildedir “1s2 2s2 2p1x 2p1y 2p1z“. Uzun spdf gösterimi küresel simetriyi göstermekte daha başarılıdır. Aşağıdaki görselde diğer elementlerin orbital dağılımlarını bulabilirsiniz.
Kaynakça :Webders.net - bikifi.com
İyonların elektronları orbitallere yerleştirilirken, öncelikle en az enerjili orbital doldurulmaya başlanır (Aufbau ilkesi). Örneğin atom numarası 7 olan azot atomunun elektron dağılımını şu şekilde yazabiliriz; “1s2 2s2 2p3)”. Bu şekildeki yazıma kısa spdf gösterimi denmektedir. Aynı atomun uzun spdf gösterimi ise şu şekildedir “1s2 2s2 2p1x 2p1y 2p1z“. Uzun spdf gösterimi küresel simetriyi göstermekte daha başarılıdır. Aşağıdaki görselde diğer elementlerin orbital dağılımlarını bulabilirsiniz.
Kaynakça :Webders.net - bikifi.com



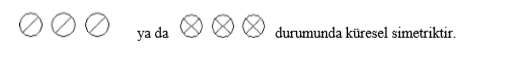
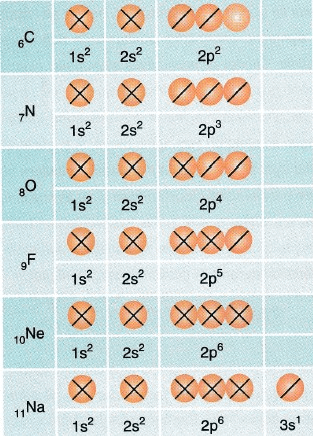
Yorumlar
Yorum Gönder